2021年7月30日,华夏源细胞工程集团股份有限公司自主研发的I类生物制品,“ELPIS人脐带间充质干细胞注射液”IND申请获得国家药监局药品审评中心(CDE)受理(受理号:CXSL2101224)。
此次IND申请的受理,是华夏源干细胞新药研发管线的里程碑,也是我国首款受理的用于银屑病治疗的干细胞新药,具有重要意义。
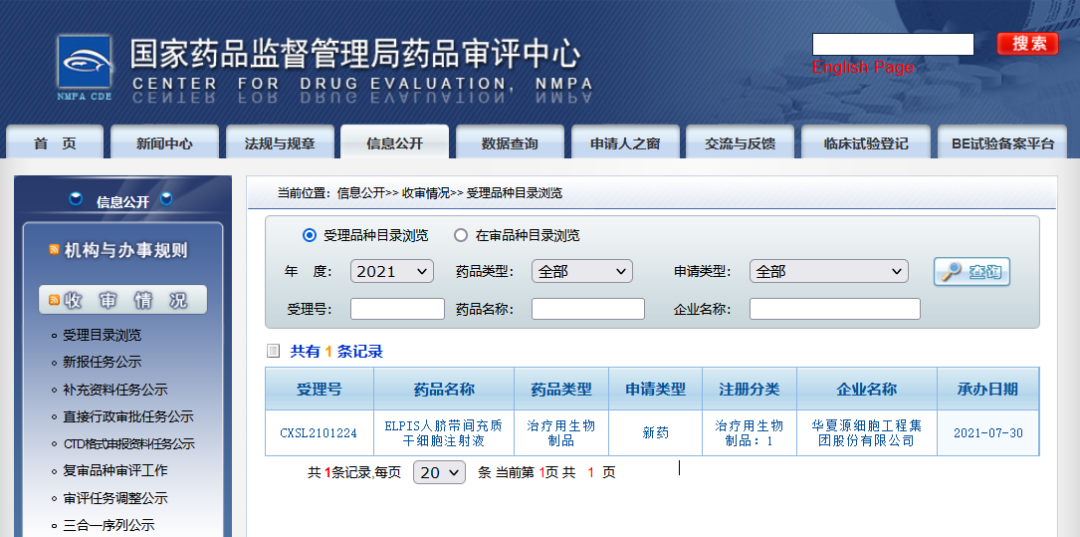
△ 国家药监局官网:华夏源“ELPIS人脐带间充质干细胞注射”IND申请受理公示
CDE,即国家药品监督管理局药品审评中心,是国家食品药品监督管理局药品注册技术审评机构,按照国家食品药品监督管理局颁布的药品注册管理有关规章,负责组织对药品注册申请进行技术审评,组织开展相关的综合评审工作。
IND,即新药临床试验,是药物研发企业以注册目的,在药品正式上市前,向CDE提供足够信息来证明药品在人体进行试验是安全的,以及证明针对研究目的的临床方案设计是合理的而开展的人体临床试验。
银屑病是一种遗传与环境共同作用诱发的免疫介导的慢性、复发性、炎症性、系统性疾病,临床表现为鳞屑性红斑或斑块。中重度银屑病患者常伴有内脏及关节损害,罹患代谢综合征和动脉粥样硬化性心血管疾病的风险增加。临床目前尚无根治银屑病的特效药,主流治疗方案旨在控制病情、缓解症状。常用系统性药物包括维生素D3衍生物、维A酸类药、糖皮质激素、免疫抑制剂等,但常伴随十分严重的副作用。
干细胞疗法是通过干细胞移植来替代、修复患者损失的细胞,或发挥免疫调节、血管再生等功能,以达到治疗疾病的目的。这一“再生医学技术”被誉为继药物治疗和手术治疗之后的第三次医学革命,是近年来国际医学前沿重点发展领域。
截至2020年6月30日,全球已有41款干细胞产品获批上市,分布于美国、欧盟、韩国、加拿大、澳大利亚和日本等地。近年来,在国家和地方的共同推动下,我国干细胞临床研究和转化应用迈入加速发展阶段。2021年5月11日,国家科技部发布《“干细胞研究与器官修复”重点专项2021年度项目申报指南》,部署5项重点任务,拟支持17个项目。
华夏源ELPIS人脐带间充质干细胞注射液是国内首个受理的用于银屑病治疗的干细胞新药。基于间充质干细胞能有效调节导致银屑病发病的“关键环节”-Th17/调节性T细胞 (Treg) 免疫失衡的机制,干细胞可以从根本上安全有效地解决银屑病的“发病根源”,从疾病的本质去治疗并攻克银屑病。
此外,基于干细胞的免疫调控及再生修复特性,ELPIS注射液有望用于多种其他适应症,囊括了非特异性炎症、组织再生、自身免疫病等方向,去满足更多“尚未满足的临床需求”。同时,相比于传统自体干细胞治疗,同种异体间充质干细胞移植安全性高、易于取材、便于规模化生产,属于“off-the-shelf”现货型产品,能够适应更广泛的临床需求与商业化场景。
华夏源科研团队将秉持初心,响应政策号召,高质量地推动干细胞产品临床研究,将更多的技术储备传化为临床可靠的产品,为更多患者带来福音,践行推动细胞科技惠及普罗大众的理念。
 沪公网安备 31011202009862号 沪ICP备18026206号 -1
沪公网安备 31011202009862号 沪ICP备18026206号 -1


